1. 결정화(Crystallization) : 분리기술의 일종으로 액체 혹은 기체의 균일상으로부터 공정을 통하여 고체입자, 즉 결정(Crystal)을 얻는 것
2. 실리콘 웨이퍼(Wafer)읠 경우 성장속도 및 방법에 따라 전자의 이동특성이 달라지며 결정의 면과 방향에 따라 원자의 배열이 달라지게 되므로 반도체 결정의 결합특성이 다르게 나타나고 또한 결정을 이루는 결합의 형태에 따라 그 특성이 달라진다.
3. 반도체에서 결정구조를 나타내기 위해 단위셀을 이용하며 결정격자는 단위셀의 특징을 결정 하는데에 매우 중요한 요인이 된다.
4. 결정면(Crystal Orientation)의 방향을 결정하는데 있어서 밀러지수(Miller Index)라는 격자 좌표 시스템, 즉 격자내의 평면의 위치나 벡터의 방향을 3개의 정수로 된 3축 좌표계(hkl)의 3가지 지수를 사용한다.
5, 밀러지수 : 면이 x, y, z 축과 만나는 점을 표시하고 이것의 역수를 취하여 간단한 정수 형태로 만드는 표시법을 의미한다.
6. 밀러지수를 사용하여 결정의 면을 표시하는 과정
1) 각 축(x, y, z)의 면과 결정축과의 만나는 지점을 정수배로 표시한다.
2) 이들 세 값(정수)의 역수를 취하고 이들의 최소 공배수(3개 값의 공통수를 곱하거나 나누어 최소의 정수)로 바꾼다.
3) 정수를 면(hkl)(둥근 괄호 안에 콤마 없이 표시)으로 표시한다.
4) 원점의 음(-)의 방향은 바(Bar)나 음의 부호를 지수에 붙여 표시한다.
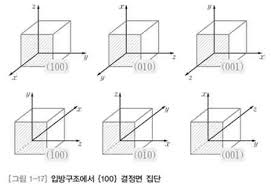
7. 공유결합(Covalent Bond) : 두 원자가 가 전자를 상호 공유함으로써 공유한 전자들 사이에 양자역학적인 상호작용에 의해 결합이 생성되는 결합
8. 공유결합은 인접 원자들간 가 전자의 공유에 의해 결합이 생셩되므로 매우 단단하며 융점이 높고 저온에서의 전기전도도가 낮은 특성이 있다.
9. 0˚[K]에서 전도에 기여할 수 있는 자유전자가 없다.
10. 전자는 열적 또는 광학적으로 여기(excitation)되어 공유결합을 벗어나 전기전도도에 기여 가능
11. 매우 단단한 고체로 고 융점
12. 다이아몬드 격자구조를 가지는 반도체(Si, Ge, C 등)
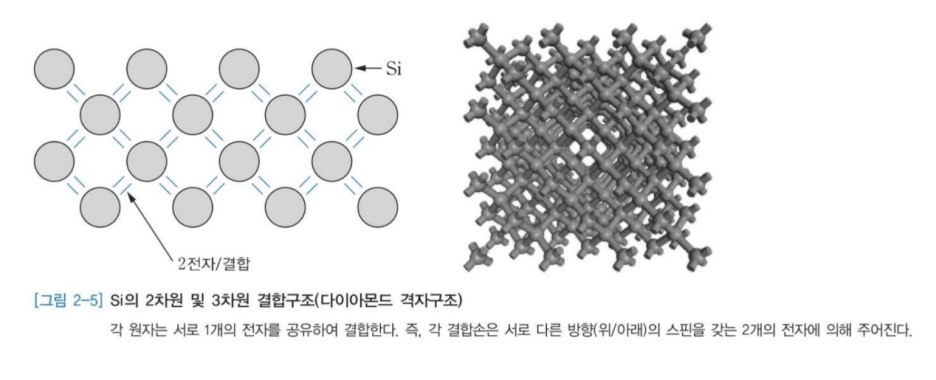
13. 이온결합(Ionic Bond) : 서로 반대되는 이온들 사이의 정전기적 인력에 의해 이루어지는결합
14. NaCl에서 Na는 최외각 전자 하나를 Cl에게 내주어 Na+가 되고 Cl은 전자를 받아 Cl-로 되며 Na+과 Cl- 사이는 쿨롱의 힘(Coulomb's Force)이 작용하여 격자를 서로 잡아당겨 반발력과 평형을 이루어 결합을 하게 된다.
15. NaCl의 경우 최외각 궤도가 모두 전자로 채워져 있어 전자의 흐름에 기여할 수 있는 전자가 없으므로 절연체의 역할을 하며 고온에서는 전지전도도가 크고 전해액에 잘 녹는 특성이 있다.
16. 전지적, 열적 절연성이 우수하나 깨지기 쉬움.
17. 낮은 전기 전도도
18. 금속보다 높은 용융점
19. 알칼리 할로겐 화합물(NaBr, KI, LiF, MgCl2 등)
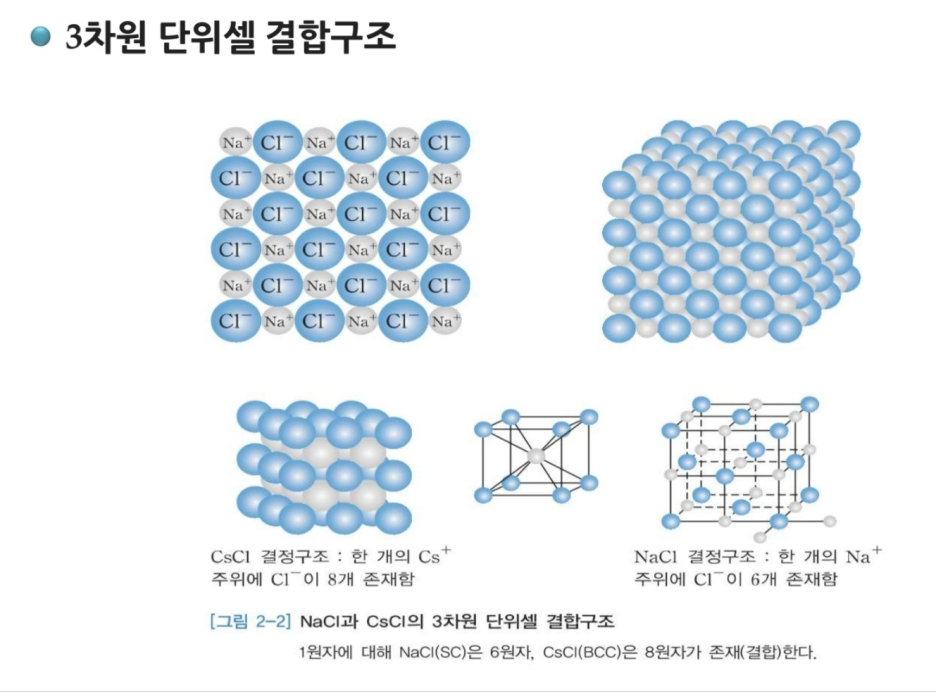
20. 금속결합(Metallic Bond) : 두 원자들이 부분적인 전자들에 의하여 구속되지 않거나 약하게 속박되어 있는 결합
21. 전자구름(Electron Cloud) : 금속결합은 원자의 최외각 전자들이 금속을 자유롭게 이동할 수 있는 결합으로 이러한 자유전자들을 무리
22. 높은 전기전도도와 우수한 열전도
23. (+)이온인 금속이온이 규칙적으로 배열
24. 자유전자의 이동이 자유로움
25. 금속의 결합(Na, Fe, Cu, Al, Au, Ag, Li 등)
26. 반데르왈스결합(Van Der Waals) : 원자를 둘러싸고 있는 전자의 변화에 의해 발생하는 약한 정전기적 인력에 의해 두 원자가 결합.
27. 집합체의 구성 요소인 원자, 분자의 수가 많은 경우에는 반데르왈스 클러스터라고 한다.
28. 대표적인 결합은 희귀가스 원자와 화학적으로 안정된 분자로 이루어진 Xe2, (CO2)2 등이 있다.
29. 최외각전자가 완전히 채워져 있어 안정된 전자이온화 에너지를 가짐.
30. 상온에서는 기체, 충분히 낮은 온도에서는 액체나 고체 상태
31. 원자간 결합력은 약 0.1[eV]
32. 비활성가스의 결합(He, Ne, Ar 등)
'전공자료' 카테고리의 다른 글
| 디지털 논리회로 게이트 종류 (0) | 2023.03.18 |
|---|---|
| MIM Capacitor Process Flow (0) | 2023.03.16 |
| 물질의 구조 (0) | 2023.03.14 |
| 반도체의 개요 (0) | 2023.03.13 |
| 원자와 전자 (0) | 2023.03.12 |



